今回は、反応速度論を勉強していくと現れる「連鎖反応」について扱っていきます!
連鎖反応の定義
連鎖反応とは、
反応途中の素過程で生じる中間体が別の中間体を作り出すような反応
のことです!
これを聞いてわかりましたか? 僕は分かりませんでした
「これで連鎖反応は理解し終えたぜ(キリッ( • ̀ω•́ )」って人はブラウザバックしてもらって大丈夫です(笑)
ここからはもっと分かりやすく説明するために、臭素分子の反応を例に挙げて説明していきます!
具体例
連鎖反応である臭化水素の生成は全体として次のように起こります。
$$\ce{H2 + Br2 -> 2HBr}$$
これを素反応に分けると、以下の5つに分かれます。
\(\ce{Br2 -> 2Br*}\) (1)
\(\ce{Br* + H2 -> HBr + H*}\) (2)
\(\ce{H* +Br2 ->HBR + Br*}\) (3)
\(\ce{H* + HBr -> H2 + Br*}\) (4)
\(\ce{2Br* -> Br2}\) (5)
〈各素反応の名称〉
連鎖反応をスタートさせる(1)が、開始反応
中間体→別の中間体となる(2),(3)が連鎖成長
正反応を阻害している(4)が連鎖阻害
ラジカル(中間体)が消える(5)が連鎖停止 です。
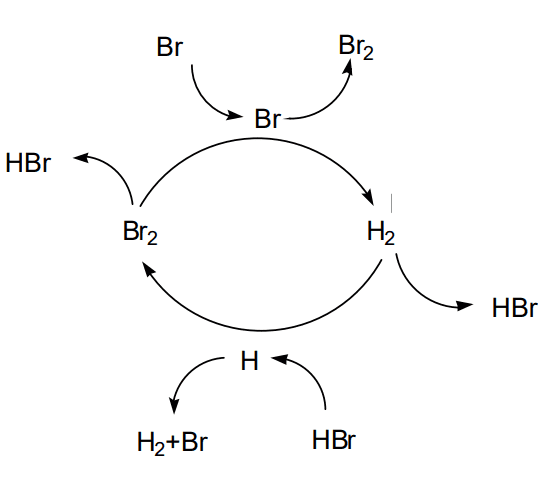
素反応の分類と名称も覚えておきましょう!
練習問題
問題
メタンの水素化は、次の反応機構で進むもとする。
\(\ce{Cl2 -> 2Cl*} \)・・・(1)
\(\ce{Cl* + CH4 -> HCl + CH3*} \)・・・(2)
\(\ce{CH3* + Cl2 -> CH3Cl + Cl*} \)・・・(3)
\(\ce{Cl* + CH4 -> HCl + CH3*} \)・・・(4)
\(\ce{CH3* + Cl2 -> CH3Cl + Cl*}\)・・・(5)
このとき以下の問題に答えよ。
(a) 反応(1)から(5)のうち、開始反応と成長反応はそれぞれどれか。
(b) この機構には停止反応が含まれていないが、どのような停止反応が考えられるか?
解答
(a)
反応(1)はラジカルではない分子からラジカルを発生しているので、これが開始反応。
反応(2)から(5)は原料と生成物の両方にラジカルが含まれているので、これらが成長反応。
(b)
停止反応は原料がラジカル、生成物が非ラジカルだから、
考えられるのは以下の3つ。
\(\ce{Cl* + Cl* ->Cl2}\)
\(\ce{Cl* + CH3* -> CH3Cl}\)
\(\ce{CH3* + CH3* -> CH3CH3}\)
今回はこれで以上!!!

コメント