高校化学で、”アセチレンはエタンやエチレンより電離しやすい”ってならったことを覚えていますか?
その時は、「そういうもんか」とただ暗記するしかなかったですが、混成軌道をならう大学化学では、ついにその理由を説明できます!
今回の話はエタン・エチレン・アセチレンがどのような混成をしてるかを知っていないとやや難しいです。
目次
それぞれの混成の確認
- エタン:sp3
- エチレン:sp2
- アセチレン:sp
ですよね。
軌道のエネルギー
図を描いてみました。汚いけど。
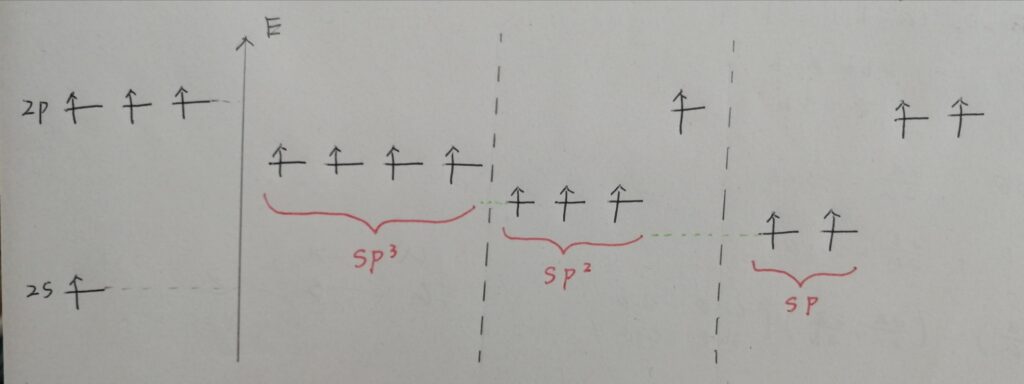
この図より、軌道のエネルギーがsp3>sp2>spの様になっているのが分かると思います。
ということは、電子を受け入れる相対的な能力は、\(\ce{HC#C^- > H_2C=CH^- > CH_3CH_2^-}\)となります。
最期に平衡を考える
後は平衡を考えて終わりです!
さっき考えたことから、\(\ce{HC#C^- > H_2C=CH^- > CH_3CH_2^-}\)の順に安定であるので、
平衡は、
\(\ce{HC#CH <=> H^+ + HC#C^-}\) ←一番右に傾く
\(\ce{H_2C=CH_2 <=> H^+ + H_2C=CH^-}\) ←二番目に右に傾く
\(\ce{CH_3CH_3 <=> H^+ + CH_3CH_2^-}\) ←三番目に右に傾く
まとめ
以上から、酸の強さは、
\(\ce{HC#CH > H_2C=CH_2 > CH_3CH_3}\)
の順になりますね!!!

コメント