「酢酸は弱酸、硫酸は強酸…これは暗記!」 高校化学で酸と塩基を習うとき、多くの酸について「強酸」「弱酸」を覚えますよね。でも、「なぜ酢酸は水に少ししか電離しない弱酸で、硫酸はバッチリ電離する強酸なんだろう?」と、その理由まで深く考えたことはありますか?
実は、その秘密は酸の分子構造に隠されています。分子の形や電子の状態が、酸としての強さを大きく左右しているのです。この記事では、高校化学の知識に少しだけ大学化学の視点をプラスして、
- 酸の強さが決まる「本当の理由」とは?
- 酢酸が弱酸である分子構造的なワケ
- 硫酸が強酸である分子構造的なワケ
- 分子構造から酸性度を予測するヒント
などを、わかりやすく、そして「なるほど!」と納得できるように解説していきます。この記事を読めば、ただの暗記だった酸の強弱が、面白いほど論理的に見えてくるはずです!
そもそも酸って何だっけ?【高校化学のおさらい】
まず基本の確認です。酸とは、ブレンステッド・ローリーの定義によれば、「陽子(textH+)を他に与える物質」のことでしたね。水溶液中では、この H+ を水分子に渡して、オキソニウムイオン (H3O+) を生じます。
\(\large{\ce{HA + H2O \rightarrow A- + H3O+}}\)
酸の強さは、この反応がどれだけ右に進みやすいか、つまりどれだけ H+ を放出しやすいか(電離しやすいか)で決まります。高校化学では、電離度 \(\alpha\) が大きいほど強い酸と学びましたね。
酸の強さの秘密は「共役塩基の安定性」にあり!
では、H+ の放出しやすさは何で決まるのでしょうか? ここで超重要なキーワードが登場します。それは「共役塩基 (A−) の安定性」です!
酸 (HA) が H+ を手放すと、残った部分が陰イオン (A−) になります。これが酸 (HA) の共役塩基です。
- もし共役塩基 (A−) が非常に安定なら… A− は「H+ がいなくても私、大丈夫!」と安定していられるので、HA はためらわずに H+ を手放します。その結果、電離が進み、強い酸となります。
- もし共役塩基 (A−) が不安定なら… A− は「H+ がいないと不安…返して!」とすぐにH+ を取り戻そうとします。その結果、電離はあまり進まず、弱い酸となります。
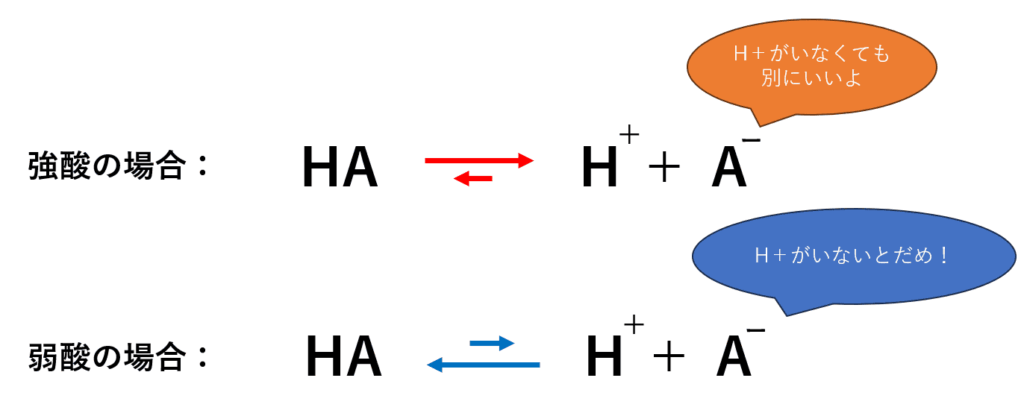
つまり、「共役塩基が安定なほど、元の酸は強くなる」という大原則があるのです。これを頭に入れて、酢酸と硫酸を見ていきましょう!
弱酸の代表:酢酸 (CH3COOH) はなぜ弱い?
お酢の主成分である酢酸 (CH3COOH) は、カルボキシ基 (−COOH) を持つ有機化合物です。酢酸が H+ を放出すると、共役塩基である酢酸イオン (CH3COO−) ができます。
\(\large{\ce{CH3COOH \rightarrow H^+ + CH3COO-}}\)
酢酸イオンの安定性①:共鳴による電荷の分散
酢酸イオンの構造を見てみると、カルボキシ基のマイナス電荷 (O− の部分) は、実は2つの酸素原子の間で分散されています。これは「共鳴」という現象で、電子が特定の場所に固定されず、複数の原子にまたがって非局在化することで分子全体が安定化する効果があります。
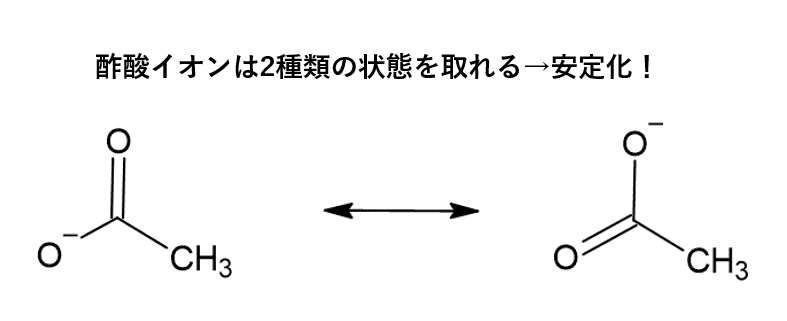
この共鳴のおかげで、酢酸イオンはただ1つの酸素原子にマイナス電荷が集中している場合よりも安定になります。これが、カルボン酸がある程度の酸性を示す理由の一つです。
酢酸イオンの安定性②:メチル基からの電子供与性(不安定化!)
しかし、酢酸イオンにはもう一つ考慮すべき点があります。それはメチル基 (CH3−) の存在です。メチル基のようなアルキル基は、一般的に電子を押し出す性質(電子供与性の誘起効果)を持っています。
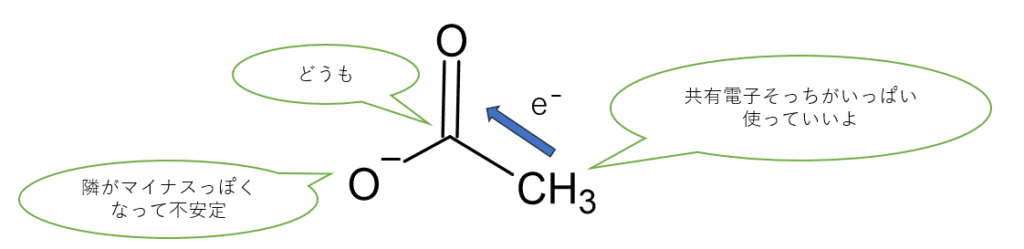
マイナス電荷を帯びているカルボキシラート部分 (−COO−) に対して、メチル基がさらに電子を押し込んでしまうと、マイナス電荷がより強められる(集中しやすくなる)ことになり、これは酢酸イオンをやや不安定化させる方向に働きます。
酢酸の結論
酢酸イオンは共鳴によってある程度安定化されるものの、メチル基の電子供与性がその安定化を少し妨げています。結果として、酢酸イオンは「そこそこ安定」ではありますが、「ものすごく安定」というわけではありません。そのため、酢酸は H+ を完全に手放しきれず、一部だけが電離する弱酸となるのです。
強酸の代表:硫酸 (H2SO4) はなぜ強い?
次に、強酸の代表格である硫酸 (H2SO4) を見てみましょう。硫酸は2段階で電離しますが、まず1段階目の電離が非常に強い酸性を示します。
\(\large{\ce{H2SO4→H+ + HSO4−}}\)
このときできる共役塩基は硫酸水素イオン (HSO4−) です。
硫酸水素イオンの安定性①:圧倒的な共鳴の効果
硫酸水素イオンの構造をよく見てみると、中心の硫黄原子 (S) に、H+ が取れた酸素原子 (O−) 1つ、ヒドロキシ基 (−OH) 1つ、そして酸素原子2つが二重結合 (S=O) で結合しています。
この O− のマイナス電荷は、なんと3つの酸素原子(O− と2つの S=O のO)にわたって非常に広範囲に分散されます。酢酸イオンの共鳴(2つの酸素原子間)よりも、はるかに多くの原子に電荷が分散されるため、非常に安定化されます。
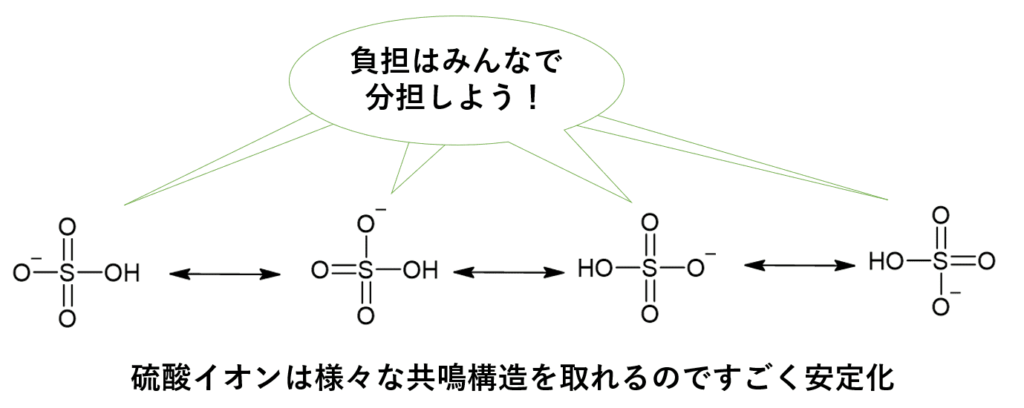
硫酸水素イオンの安定性②:電気陰性度の高い酸素原子による誘起効果
さらに、硫黄原子に直接結合している酸素原子は電気陰性度が非常に大きいため、硫黄原子から電子を強く引きつけます。この効果(電子求引性の誘起効果といいます)は、O− に局在しがちなマイナス電荷をさらに分散させ、硫酸水素イオンをより一層安定化させる方向に働きます。
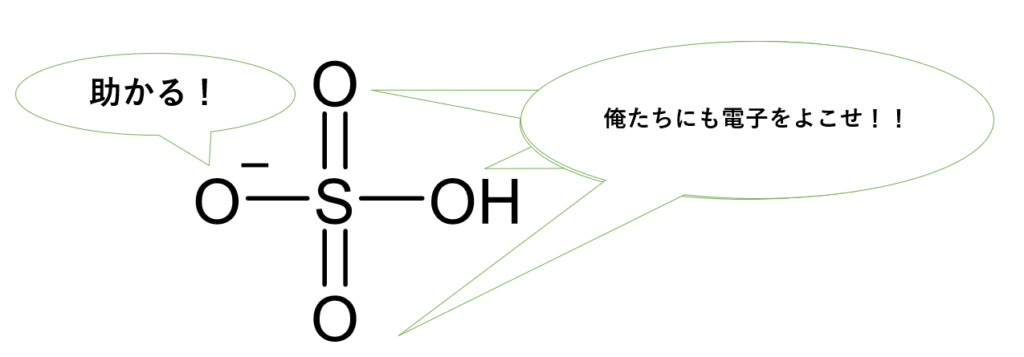
硫酸の結論(1段階目の電離)
硫酸水素イオン (HSO4−) は、広範囲な共鳴効果と、電気陰性度の高い酸素原子による強い誘起効果によって、極めて安定なイオンとなります。そのため、元の硫酸 (H2SO4) はいとも簡単に1つ目の H+ を手放し、非常に強い酸性を示すのです。
(ちなみに、2段階目の電離 \(\ce{HSO4- rightleftharpoonstextH+ + SO_4^{2-}}\) は、すでにマイナスに荷電した HSO4− からさらに H+ を引き離すため、1段階目よりは弱くなりますが、SO42− イオンも非常に安定なので、硫酸水素イオンも比較的強い酸です。)
📝 酸の強さを支配する!分子構造のキーポイントまとめ
酢酸と硫酸の例から、酸の強さを決める分子構造上の要因が見えてきましたね。一般的に、以下の要素が重要になります。
- 共役塩基の共鳴安定化: マイナス電荷がより多くの原子に、より効果的に分散される(共鳴構造が多く描ける、より電気陰性度の高い原子上に分散するなど)ほど、共役塩基は安定になり、元の酸は強くなります。
- 誘起効果:
- 電子求引性基(電気陰性度の大きな原子や官能基、例: ハロゲン、ニトロ基など)が近くにあると、共役塩基のマイナス電荷を吸い取って安定化させ、酸性度を強めます。
- 電子供与性基(例: アルキル基など)が近くにあると、共役塩基のマイナス電荷を強めて不安定化させ、酸性度を弱めます。
- 電気陰性度と原子サイズ (H+ が結合している原子そのものの性質):
- 同じ周期なら、H+ を放出する原子の電気陰性度が高いほど、結合の極性が大きくなり H+ を放出しやすく、酸性は強くなります (例: \(\ce{CH_4 < NH_3 < H_2O < HF}\)
- 同じ族なら、H+ を放出する原子のサイズが大きいほど、H−A 結合が弱く、また生じたアニオンの電荷が広い範囲に分散できるため、酸性は強くなります (例: HF < HCl < HBr < HI)。
酢酸と硫酸だけじゃない!広がる分子構造と酸性度の世界
これらの考え方は、酢酸や硫酸だけでなく、様々な酸の強弱を理解するのに役立ちます。
共役塩基の硝酸イオン (NO3−) が3つの酸素原子にわたる共鳴で安定化されるから。
共役塩基のフェノキシドイオンがベンゼン環全体に共鳴で安定化されるから(ただしカルボン酸よりは弱い)。
ギ酸には電子供与性のメチル基がなく、酢酸より共役塩基が相対的に安定だから。
このように、分子の形や電子の状態をじっくり見ることで、酸性度の「なぜ?」が解き明かされていくのは、化学の面白いところですね!
まとめ:酸の強弱は分子構造によって決まる!
今回は、酢酸と硫酸を例に、なぜ酸の強さに違いが生まれるのかを分子構造の視点から探求しました。
- 酸の強さは、H+ を放出した後の共役塩基の安定性で決まる!
- 酢酸イオン (CH3COO−) は共鳴で安定化されるが、メチル基の影響で「そこそこ安定」。だから酢酸は弱酸。
- 硫酸水素イオン (HSO4−) は広範囲な共鳴と強い誘起効果で「ものすごく安定」。だから硫酸は強酸。
- 共鳴効果や誘起効果といった電子の偏りが、安定性を左右する重要なカギ。
高校化学では「強酸はこれ、弱酸はこれ」と覚えることが多いですが、その背景には分子レベルでの深い理由があります。この記事が、皆さんの化学への興味をさらに深め、「なぜだろう?」を考えるきっかけになれば嬉しいです。
分子の形を想像しながら、その性質を考えてみると、化学はもっともっと面白くなりますよ!

コメント