有機化学を勉強していると必ず登場する概念が「共鳴(resonance)」。
教科書には複数の構造式が並んで “↔” で結ばれているけれど、「結局どれが本物なの?」「どうやって書けばいいの?」と疑問に思ったことはありませんか?
この記事では、共鳴構造式の意味・書き方・良い共鳴構造の判断基準まで、大学生向けに丁寧に解説します。
共鳴(Resonance)とは?
1つの構造式だけでは表せない電子の分布を表すための考え方
有機分子の中には、電子が特定の位置に固定されていない場合があります。
しかし、通常のルイス構造式(電子式)では、電子対や結合を「特定の位置」に書く必要があります。
そこで登場するのが 共鳴構造式。
共鳴構造式=実際の分子を複数の仮想的な構造式で表したもの
(実在するのはそのどれでもなく、”共鳴混成体=平均像”)
例:ベンゼンは六角形に単結合と二重結合を交互に描くが、
実際にはすべての炭素–炭素結合が同じ長さ。
共鳴構造は“実在”するのか?
よくある誤解ですが、描いた共鳴構造式はどれも実在しません。
現実に存在するのは、電子が分散した 共鳴混成体(resonance hybrid)。
共鳴構造式はあくまで「電子がどのように非局在化しているか」を理解するためのモデルです。
共鳴構造式の書き方
共鳴構造を書く際に知っておくべきことは次の通りです。
① 原子の位置は変えない
核の位置(原子の配置)はそのまま。
動かして良いのは 電子(π電子、非共有電子対)だけ。
② 電子の移動は曲線矢印(curved arrow)で表す
- **2本線の矢印(↔)**で共鳴構造同士を結ぶ
- 電子の移動は “尾=電子の出発” → “矢じり=電子の到着”
- 電子の移動を表す矢印は片矢印!!!
③ 基本は1つの原子に8電子まで
特に第2周期元素(C, N, O, F)は 最大8電子。
ただし、6電子になることは意外とあります!
④ 化合物全体で見たとき、トータルの電荷は同じになる
これは当たり前なのですが、共鳴構造式の一つ一つの電荷は一定です。元の電荷がゼロなら、どの共鳴構造式のトータルの電荷はゼロになります。
構造を書いた後は形式電荷に矛盾がないか確認するクセをつけるといいと思います。
⑤ 共鳴可能なパターンを覚える
よく出るパターンは以下の5つ:
- π結合と孤立電子対
- π結合が連なる共役系
- カルボニル基(C=O)の電子移動
- カルボカチオンを含む場合
- 芳香族環(ベンゼンなど)
例題:炭酸イオン(CO2-)
炭酸イオン(CO2-)の共鳴構造式を書け。
今回の共鳴構造式はカルボニル基(C=O)の電子移動が大事になってきます。
答え
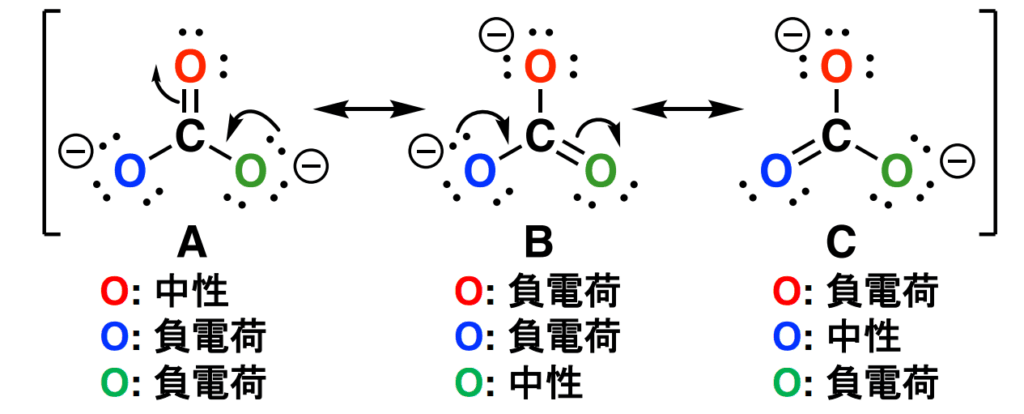
「カルボニル基のC=Oの二重結合は、片方の電子がO原子の上に移動して単結合を形成する共鳴構造を取りやすい」という事実は覚えておくといいと思います。
どの共鳴構造がより“よい”のか?(安定性の判断基準)
複数の共鳴構造が描けるとき、全てが同じ寄与をするわけではありません。
より安定な構造の寄与が大きくなります。
【安定な共鳴構造を見分けるポイント】
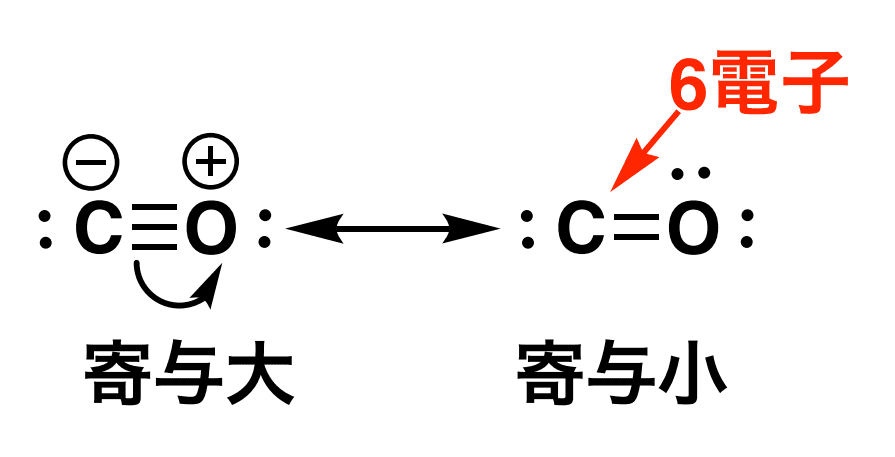
①8電子則を満たす原子数が最大になる構造である
基本的にはオクテット則を満たす原子数が最大なやつが安定で、そのために寄与が大きいです。
② 形式電荷が少ない
形式電荷が少ない構造ほど安定。
つまり、「+」とか「ー」とかが構造式にないほうが安定ということです。
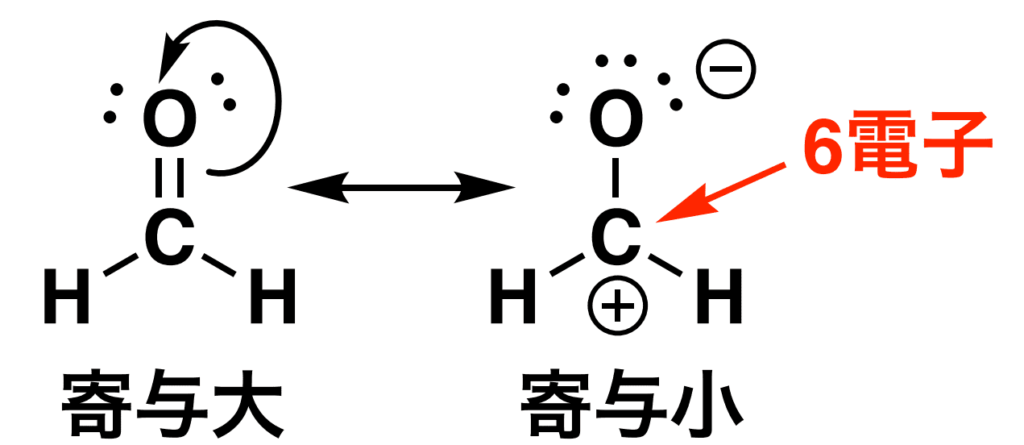
③ 電荷は適切な原子にある(電気陰性度に注目)
- 負電荷 → 電気陰性度の高い原子(O、Nなど)
- 正電荷 → 電気陰性度の低い原子(Cなど)
電気陰性度が高い原子の上に電子がある方が当然安定ですよね。
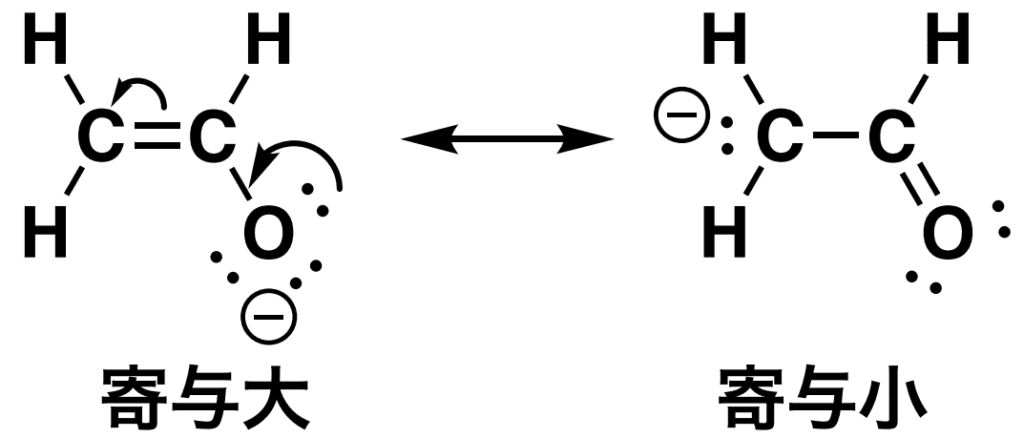
④ 電荷は距離が離れている
正電荷と負電荷が隣り合うとエネルギーが高くなります。
これは近いとお互いを引き合う力が強くなるためだと考えてください。
⑤ 芳香族性が保たれる構造である
ベンゼン環など芳香族性を維持する構造が優勢。
この効果はかなり強いので、ベンゼン環が出てくる共鳴構造式を見たら、必ずこのルールを考えなくてはいけません!忘れがち!
練習問題
練習問題を1問だけですが用意しました。
ギ酸(HCOOH)の共鳴構造式を書いて、寄与が大きい構造を選べ。
ヒント
ギ酸はカルボニル基を持っているので、そこを使って共鳴構造式が書けそうですね。
解答
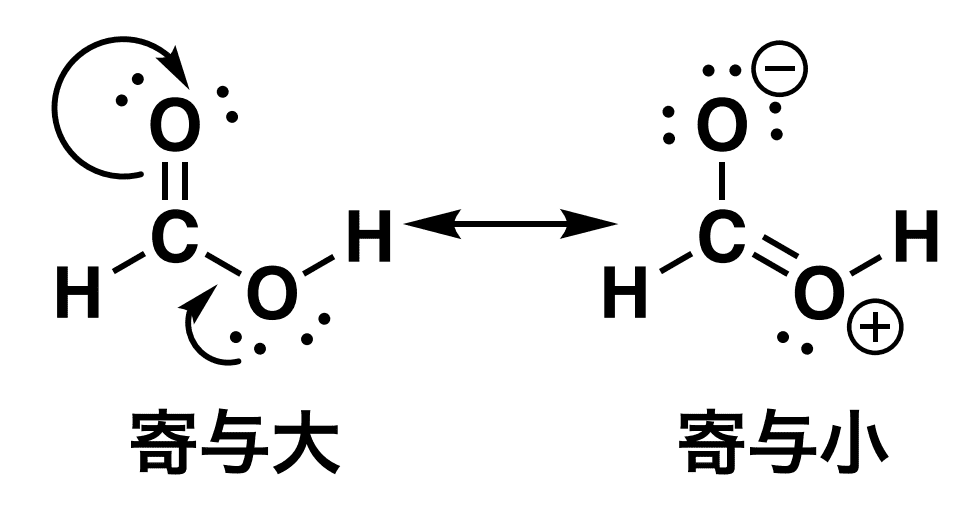
共鳴構造を書くと何が理解しやすくなる?
反応性の予測
共鳴構造式の寄与が大きい構造がその分子の構造だとみなせるので、求核攻撃を受けやすい位置(+電荷が現れる位置)が分かります。
これは有機化学を学んでいくとものすごく大事になってきます!
電子の非局在化による安定性
例えばですが、カルボキシラートイオン(–COO⁻)は共鳴により負電荷が酸素に分散するため非常に安定になります。
このために酢酸(CH3COOH)は弱いながらも酸であるのですね。
まとめ
- 共鳴構造式は 実在しない“仮想的な構造”
- 実在するのは電子が非局在化した 共鳴混成体
- 共鳴構造を書くときは 原子は動かさず、電子だけを動かす
- 形式電荷・オクテット・電気陰性度を必ずチェック
- 共鳴は 反応性や安定性を理解するための重要なツール
共鳴構造は有機化学の基礎ですが、反応機構を理解する上で欠かせない概念です。
練習すると驚くほど素早く書けるようになるので、ぜひ多くの分子で試してみてください。

コメント