ルイス酸とルイス塩基の概念は、化学における酸・塩基の定義の1つで、一番広く使える定義です。
この記事では、ルイス酸・塩基の定義、特徴、具体例、そしてブレンステッド・ローリーの酸・塩基との違いについてわかりやすく解説していきます!
1. ルイス酸・ルイス塩基の定義とは?
ルイス酸とルイス塩基は、それぞれ以下のように定義されます
- ルイス酸:電子対を受け取る物質
- ルイス塩基:電子対を与える物質
定義は簡単ですね。
ポイント
この定義は電子対の「受け渡し」に基づいており、水素イオンは関係ありません。
これが他のアレニウスの定義やブレンステッド・ローリーの定義と大きく違うところです。
あくまで電子で考えるというわけですね!
2. ブレンステッド・ローリーの定義との違い
ルイス酸・塩基とブレンステッド・ローリーの定義は、以下のように異なります:
| 定義 | 対象物質の例 | 特徴 |
|---|---|---|
| ブレンステッド・ローリー | H⁺(水素イオン)の受け渡し | 水溶液中の反応を主に説明 |
| ルイス酸・塩基 | 電子対の受け渡し | 水素イオンが関与しない反応にも適用可能 |
電荷の移動
- ルイス酸:電子対を受け取る → 陽イオンであることが多い
- ルイス塩基:電子対を与える → 陰イオンであることが多い
「水はルイス酸にもルイス塩基にもなり得る」って言葉を聞いたことがある人も多いのではないでしょうか?
この言葉のように、多くの物質はルイス酸とルイス塩基のどっちにもなることができます。
例えば、H2Oは電子をあげてOH–になることも、電子を貰ってH+になることもできますよね。何と反応するかでルイス酸・塩基は決まるわけです。
水がルイス酸・塩基のどっちにもなる理由(知りたい人だけ見てください)
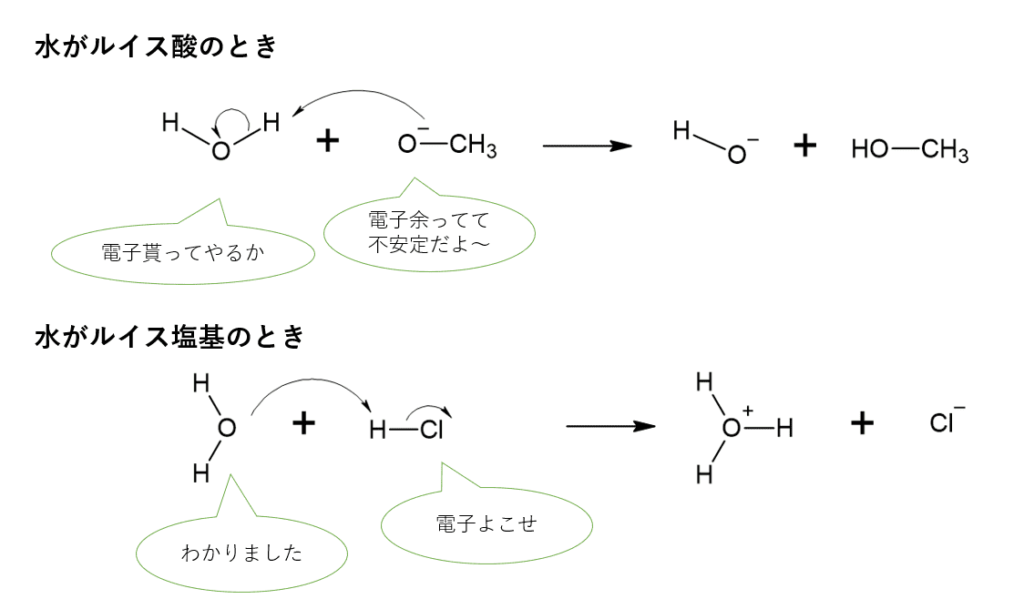
水がルイス酸のときの反応
- メトキシドイオン(メタノールのイオン)のHO–からH2Oの片方のH原子に電子が移動
- 水分子の中で、電子を貰ったHとOの共有電子対がOに移動
この2つが起きています。
水がルイス塩基のときの反応
- H2OのO原子の非共有電子対がHClのHと共有結合を作る
- HClのH-Cl共有電子対がClの非共有電子対になる
この2つが起きています。
これらの理由で、ルイス酸・塩基の両方になれるのですね!
3. ルイス酸・塩基の具体例
ルイス酸・ルイス塩基の反応の具体例をいくつか載せておきました。
ブレンステッド・ローリーの定義の定義でも説明できる反応
1. 水素イオンと水酸化物イオン
反応式:H⁺ + OH⁻ → H₂O
- H⁺(水素イオン):ルイス酸(電子対を受け取る)
- OH⁻(水酸化物イオン):ルイス塩基(電子対を与える)
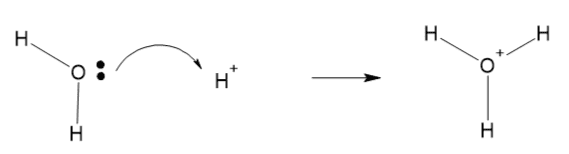
2. 酢酸と水素イオン
反応式:CH₃COO⁻ + H⁺ → CH₃COOH
- CH₃COO⁻(酢酸イオン):ルイス塩基(電子対を与える)
- H⁺(水素イオン):ルイス酸(電子対を受け取る)
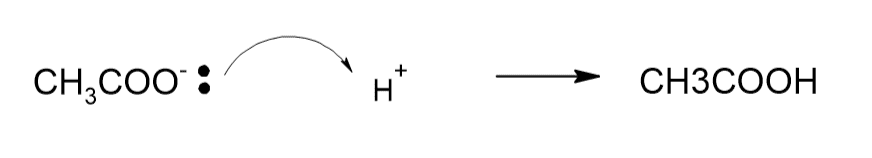
ルイス酸・塩基でのみ説明可能な反応
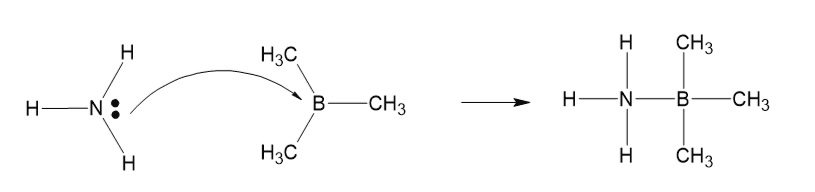
3. トリメチルボランとアンモニア
反応式:B(CH₃)₃ + NH₃ → B(CH₃)₃:NH₃
- B(CH₃)₃(トリメチルボラン):ルイス酸(電子対を受け取る)
- NH₃(アンモニア):ルイス塩基(電子対を与える)
4. メトキシドイオンとホルムアルデヒド
- メトキシドイオン(CH3O–):ルイス塩基(電子対を与える)
- ホルムアルデヒド(CH2O):ルイス酸(電子対を受け取る)
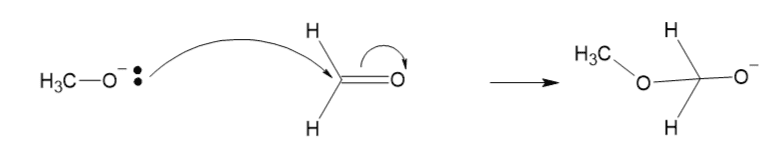
この反応は電子の動きが2回あるので、他の反応より難しいですね。
実は、ルイス塩基と求核剤は同じ
有機化学を勉強していくと、「求核剤」って言葉がよく聞こえてくるようになります。
実は「求核剤」は「ルイス塩基」と同じ意味で、「求電子剤」は「ルイス酸」と同じ意味です。
こっちの言葉の方がよく使うので、実際の所「ルイス酸」, 「ルイス塩基」って言葉はそのうち使わなくなります…
まとめ
ルイス酸とルイス塩基の考え方は、電子対の受け渡しを基準とする広範な定義です。このため、従来のブレンステッド・ローリーの定義では説明できない反応も説明できます。電子対の動きを意識することで、化学反応をより深く理解する助けとなるでしょう。
最後までお読みいただきありがとうございました!

コメント
コメント一覧 (2件)
4. メトキシドイオンとホルムアルデヒドのところで、
メトキシドイオンがルイス塩基ではないのですか?
コメントありがとうございます!
ogaさんのおっしゃる通り、メトキシドイオンの個所でルイス酸とルイス塩基が逆になっていたので修正しました。
ご指摘ありがとうございました!