化学の学習、特に分子軌道法(MO法)に進むと、「p軌道からできる分子軌道はσが1つとπが2つ」と習います。しかし、なぜ3つのp軌道がそのように分かれるのか、直感的に理解しにくいと感じる方も多いのではないでしょうか?
この記事では、その理由をp軌道の「形」と「向き」、そして「重なり方」に注目して、誰にでも分かるように解説します。
すべての基本は「結合軸」!
分子軌道を考える上で最も重要なのが、2つの原子を結ぶ直線を結合軸(または分子軸)と定義することです。一般的に、この軸をz軸と定めます。
3つのp軌道(px, py, pz)は、それぞれx, y, z軸の方向にダンベル型に伸びています。これらの軌道が、この結合軸(z軸)に対してどのように向き合っているかが、σ結合とπ結合の違いを生み出す鍵となります。
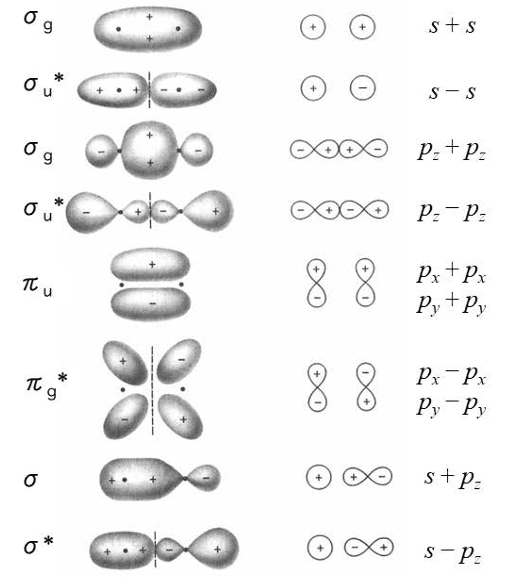
正面衝突で生まれる「σ(シグマ)結合」- pz軌道
まず、pz軌道に注目しましょう。 結合軸をz軸と定めたので、2つの原子のpz軌道は、互いにまっすぐ向き合う形になります。原子同士が近づくと、これらの軌道は正面衝突するように重なり合います。
この「正面衝突」型の重なりによって、電子は2つの原子核を結ぶ直線(結合軸)上に最も集中して存在するようになります。このような、結合軸の周りで回転させても対称な(円筒状の)分子軌道をσ軌道(シグマ軌道)と呼びます。
p軌道のうち、このように正面衝突できるのはpz軌道のペアただ1つだけです。そのため、p軌道から形成されるσ結合も1種類しか存在しません。
- pz軌道 + pz軌道 → 正面衝突 → σ結合 (1つ)
平行に重なる「π(パイ)結合」- px軌道とpy軌道
次に、残りのpx軌道とpy軌道を見てみましょう。 これらの軌道は、結合軸(z軸)に対して垂直な方向を向いています。そのため、原子同士が近づいても正面衝突することはできず、互いに側面から平行に重なり合います。
この「側面」型の重なりによって、電子は結合軸を挟んで上下(または前後)の2つの領域に存在するようになります。この分子軌道は、結合軸を含む平面(節面)を持っており、結合軸の周りで回転させると対称性が崩れます。このような分子軌道をπ軌道(パイ軌道)と呼びます。
そして重要なのは、px軌道同士のペアとpy軌道同士のペアは、互いに90°向きが違う独立した存在であるという点です。
- px軌道 + px軌道 → 側面の重なり → π結合 (1つ目)
- py軌道 + py軌道 → 側面の重なり → π結合 (2つ目)
px軌道とpy軌道はエネルギー的に等しいため、同じエネルギーを持つ2つのπ結合が形成されます。
まとめ:p軌道の組み合わせ
| 原子軌道 | 結合軸との関係 | 重なり方 | できる分子軌道 | 個数 |
| pz + pz | 平行(軸上) | 正面衝突 | σ軌道 | 1つ |
| px + px | 垂直 | 側面 | π軌道 | 1つ |
| py + py | 垂直 | 側面 | π軌道 | 1つ |
| 合計 | σ軌道1つ、π軌道2つ | 3つ |
このように、3次元空間におけるp軌道の向きによって、必然的に「正面衝突」が1パターン、「側面衝突」が2パターン生まれます。これが、p軌道から形成される分子軌道がσ軌道1つとπ軌道2つになる理由です。
この理解は、窒素分子(N₂)が持つ三重結合(σ結合1つ + π結合2つ)の成り立ちなどを考える上で不可欠となります。

コメント