目次
この記事でわかること
- 第二周期の等核二原子分子における分子軌道エネルギー準位の変化
- σ軌道とπ軌道のエネルギー順位が逆転する理由
- s–p混成(ミキシング)による影響
- 対象:B₂、C₂、N₂、O₂、F₂、Ne₂ など
分子軌道でエネルギー順位が逆転するってどういうこと?
第二周期の等核二原子分子(例:B₂、C₂、N₂、O₂、F₂など)の分子軌道エネルギー図では、途中の元素でσ2p軌道とπ2p軌道のエネルギー順位が入れ替わる現象が見られます。
具体的には以下のように変化します。
下の図を見ると、2σgと1πuのエネルギーがN2とO2を境に逆転していることが分かりますね。
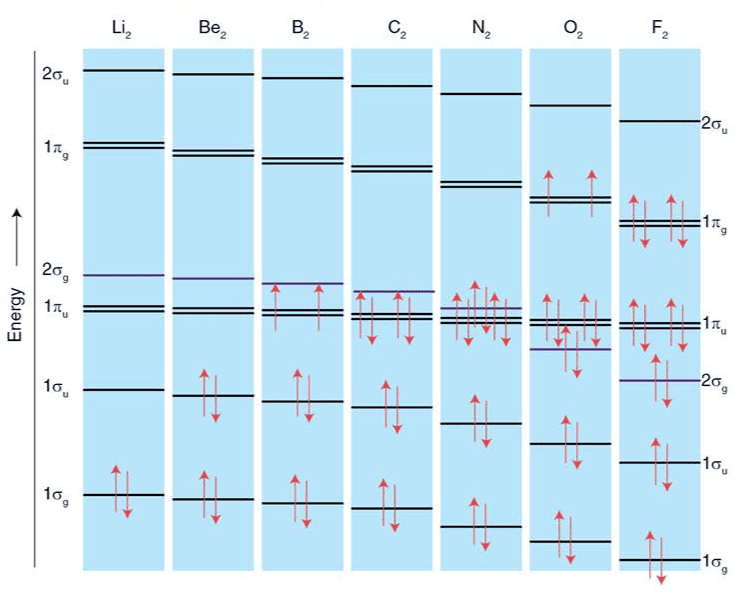
| 元素 | 軌道のエネルギー順位(高い順) |
|---|---|
| B₂, C₂, N₂ | π2p > σ2p (←逆転している) |
| O₂, F₂, Ne₂ | σ2p > π2p(←通常の順) |
この「π 軌道が σ 軌道よりも高い」という状態が、なぜ一部の元素でだけ起こるのかがこの記事の主題です。
結論:σ軌道がπ軌道より高くなるのは、s–p混成(ミキシング)のせい!
◆ s–p混成とは?
原子軌道のエネルギーが近く、対称性が一致する軌道同士は「混成(ミキシング)」が起こります。
分子軌道では以下の混成が重要です:
- σ(2s)軌道とσ(2p_z)軌道:どちらも z 軸方向の σ 対称性 → 混成できる
- π(2p_x), π(2p_y):σ 対称性ではない → 混成できない
◆ どう影響するの?
s–p混成が起きると:
- σ(2s)とσ(2p)のエネルギーが押し合い、
- σ(2p)が上に、σ(2s)が下に移動します(レベル反発)
◆ 軽い元素では混成が強い!
B₂、C₂、N₂ などの軽元素では:
- 2sと2pの原子軌道エネルギー差が小さい
- σ軌道同士の混成が強く働く
- その結果、σ2pがπ2pよりも高いエネルギー準位になってしまう!
なぜO₂以降で逆転しなくなるの?
O₂、F₂ などの重い元素では:
- 原子核の正電荷(Z)が増加し、2s軌道がより安定化(低エネルギー)
- → 2sと2pのエネルギー差が大きくなり、混成が起こりにくくなる
- → σ2p軌道は本来の低い位置に戻り、π2pよりも下位に安定
つまり、s–p混成の強さの違いがエネルギー逆転の原因なのです。
エネルギー順位の変化まとめ
| 分子 | 混成の強さ | σ2p と π2p の関係 | 結合次数や磁性への影響 |
|---|---|---|---|
| B₂, C₂, N₂ | 強い | σ2p > π2p(逆転) | π軌道に電子が入り、C₂は結合次数2 |
| O₂, F₂, Ne₂ | 弱い | σ2p < π2p(通常) | O₂はπ*に不対電子 → 常磁性! |
🔍 よくある質問(FAQ)
Q. σとπのエネルギー差はどのくらい変わるの?
A. s–p混成が強いときには、σ2pがπ2pより 0.2〜0.5 eV ほど高くなることがあります(分子による)。
Q. この現象は他の周期にも見られるの?
A. 基本的にs–p混成は2s–2p軌道のエネルギー差が小さい第二周期に特有の現象です。第三周期以降では起こりにくいです。

コメント