高校化学では「フェノールはオルト・パラ配向性」「ニトロ基はメタ配向性」と覚えますが、その理由はあまり説明されませんよね。
実はこれ、「反応の途中でできる『中間体』がどれだけ安定か」で全て決まるのです。
大学レベルの有機化学の視点を使って、ベンゼン環のドラマを覗いてみましょう。
まずは基本:反応の仕組み(求電子置換反応)
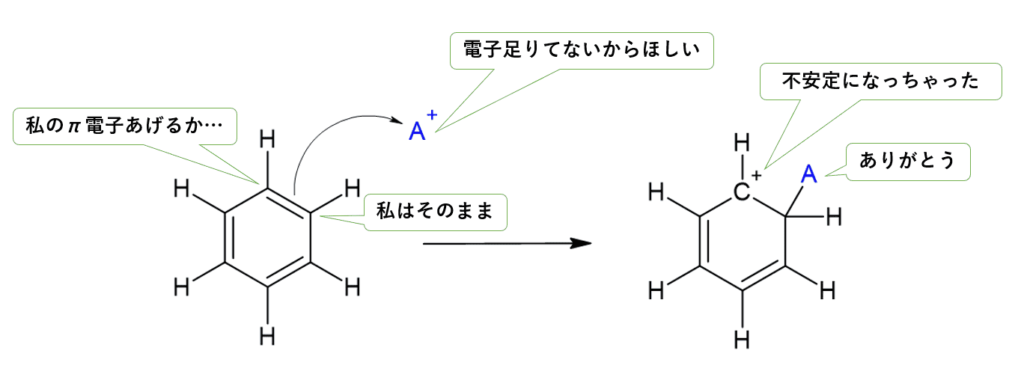
ベンゼン環は二重結合($\pi$電子)がたくさんあり、電子が豊富な場所です。
そこに、電子に飢えた試薬(求電子試薬:$E^+$とします)が近づいてくるところから反応は始まります。
- $E^+$がベンゼン環の$\pi$電子を使って結合する。
- 一時的にベンゼン環の「共鳴(安定な状態)」が崩れ、**プラスの電荷を持った不安定な状態(中間体)**ができる。
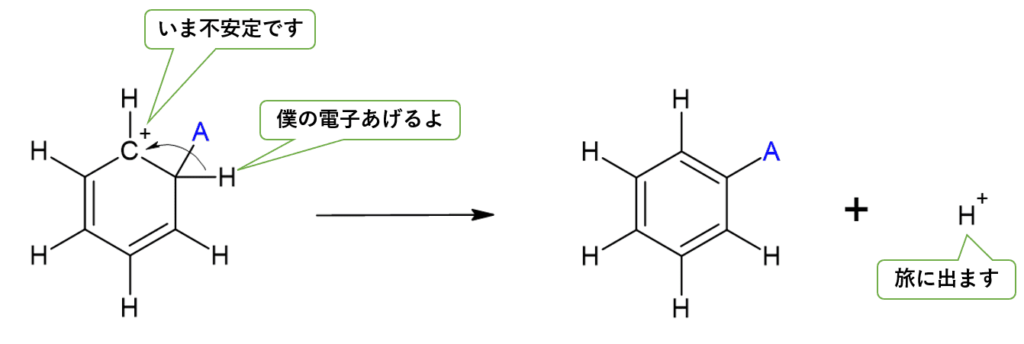
- $H^+$が抜けて、再び安定なベンゼン環に戻る。
この「2. 中間体」の安定性が運命の分かれ道です。
中間体が安定であればあるほど、その反応は進みやすくなります。

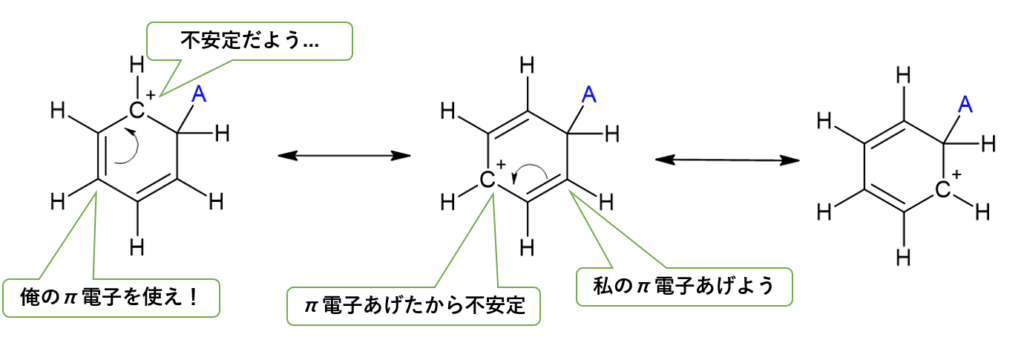
(なお、中間体はこの3つを行ったり来たりしているイメージ)
オルト・パラ配向性の正体:電子供与基(-OH, -NH2など)
ヒドロキシ基(-OH)やアミノ基(-NH2)がついている場合を考えます。これらは電子供与基と呼ばれ、ベンゼン環に電子を押し込んでくれる味方です。
ちなみに覚える手助けとして、「H(水素)」が付いてるやつは電子供与基、すなわちオルト・パラ配向になることが多いです。
オルト・パラ位を攻撃した場合
例として、-OH基が付いている場合を考えます。(-NH2基が付いている場合も同じです)
$E^+$がオルト位(隣)やパラ位(向かい)を攻撃すると、プラスの電荷がベンゼン環上を移動します(共鳴)。
この時、非常に重要なことが起こります。
- プラスの電荷が、置換基(-OH)が結合している炭素の真上に来る瞬間があるのです。
- 酸素原子($O$)には「非共有電子対」があります。これが不安定になっているところに電子を貸してくれます。
- これによって「全ての原子がオクテット則(安定な電子配置)を満たす」という最強の安定構造が描けます。
オルト位のとき

パラ位のとき

メタ位を攻撃した場合
メタ位を攻撃すると、プラスの電荷は移動しますが、決して置換基(-OH)の真上には来ません。
つまり、酸素原子からの強力な援助(電子の貸し出し)を受けられないのです。

結論:
オルト・パラ攻撃の時だけ「酸素からの援助(超安定化)」ボーナスが発生する。だから、$E^+$はオルト・パラ位に引き寄せられる。
メタ配向性の正体:電子求引基(-NO2, -COOHなど)
次は、ニトロ基(-NO2)のような電子求引基がついている場合です。これらはベンゼン環から電子を吸い取る「泥棒」のような存在です。
オルト・パラ位を攻撃した場合(最悪のシナリオ)
先ほどと同じようにプラス電荷が移動します。
すると、プラスの電荷が、置換基(-NO2)の真上に来てしまいます。
ここで悲劇が起きます。
- ベンゼン環上のプラス電荷($C^+$)
- ニトロ基のプラス電荷($N^+$)
隣同士でプラスとプラスが反発し合います。これはエネルギー的に非常に不安定(居心地が最悪)な状態です。
「こんなに不安定になるなら、オルトやパラには行きたくない!」と反応が拒絶されます。
オルト位のとき

パラ位のとき

メタ位を攻撃した場合(消去法的に一番反応しやすい)
メタ位を攻撃した場合、プラスの電荷は移動しますが、ニトロ基の真上(最悪の場所)を避けて移動できます。
「安定」というわけではありませんが、オルト・パラ攻撃時の「最悪な反発」は回避できるのです。

結論:
オルト・パラに行くと「プラス同士の反発」でとても不安定になる。メタ位で反応するのはそれを避けられる「マシなルート」だから、結果的にメタ配向性になる。
まとめ:配向性を決めるルール
大学化学の視点で整理すると、たったこれだけの話です。ただ、最初は「これだけ」が難しいと思います。
| 置換基の種類 | 特徴 | 中間体への影響 | 結果(配向性) |
| 電子供与基 (-OH, -NH2, -CH3) | 電子をくれる 非共有電子対がある | オルト・パラ攻撃時、電子を貸して劇的に安定化させる。 | オルト・パラ配向 |
| 電子求引基 (-NO2, -COOH) | 電子を吸う または自身がプラス | オルト・パラ攻撃時、プラス同士が隣り合い劇的に不安定化させる。 | メタ配向 (消去法) |

最後に
高校化学では「暗記」と言われがちですが、化学の反応性を突き詰めると、今回のような単純な物理法則が働いているだけのことも多いです。
電子の気持ちになって「どこにプラスが来たら安定かな?嫌かな?」と考えると、複雑な有機化学もパズル解きのように面白くなりますよ!

コメント