「もとの試料に○○を△△mgスパイクした」みたいな文章が出てきて困ったことはありませんか?
僕もそうでしたが、慣れないうちは「スパイクって何だよー!」とか、「何の意味があるんだよ!」とか思いがちです。
そんな人のために「スパイク」を一から解説します!
そもそもスパイクとは?
タイトルにも書きましたがスパイクとは添加のことです。
例を挙げると、「1MのKCl水溶液を5.0 mLをスパイクした」という文章は、「1MのKCl水溶液を5.0 mLを添加した」という文章とまったく同じ意味です。意外と簡単ですね。
というわけで次行きましょう。
スパイクは何のためにやる?
むしろこっちの方が大事です。
スパイク(添加)は何のためにやるのかという話ですが、結論から言うと、試料を検量するためです。
実は、スパイクするのは標準添加法という検量法の操作の一部分なんです。
というわけで少し脱線しますが、標準添加法の説明をさせてください。
標準添加法について
キーワード:濃度が二倍で測定値も二倍
標準添加法は具体例を通して説明した方が分かりやすいですが、その前に標準添加法の操作手順だけまとめておきます。
この手順に目を通してから、具体例で理解を深めていければと思っています。
以下測定の手順です。
何も添加していない試料の吸光度などを装置で測定します
例えば、海水中の鉄イオンの濃度が知りたかったら、その試料に鉄イオンを少量添加します
先ほど添加した試料の吸光度などをもう一度測定します
「添加→測定」の操作を繰り返し、データを集めます
一次関数になるのがポイントです。
キーワードにも書きましたが、試料中のある物質の濃度とその物質が測定値に及ぼす影響は比例関係にあります。
これで終わりです。
いかがでしたか?ちゃんと読みましたか?笑
これだけではよく分からないと思うので実際例を見ていきましょう。
例
未知試料中のCuイオンの濃度を求めたい。
さっきのステップ通りにやっていきましょう。
簡単のために、測定値が2だったとします。
Cuイオンを一滴入れて、Cuイオン濃度を0.5 mol/Lだけ増加させました。
もう一度測定すると、測定値が3になっていたとします。
またCuイオンを加えて濃度が0.5 mol/L増加(合計で1.0 mol/L増加)した後に測定すると、今度は測定値が4になっていたとします
得られたデータから未知濃度をxとして表を作ってみました
| Cu濃度[mol/L] | 測定値 |
|---|---|
| x | 2 |
| x+0.5 | 3 |
| x+1 | 4 |
というわけでグラフは・・・
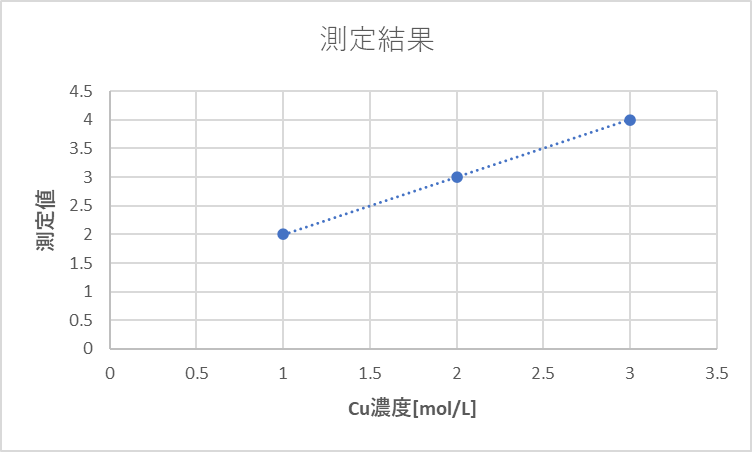
このようになります。
簡単な数字を使ったので楽勝ですね。答えは[Cu] = 0.5mol/L でした。
どうですか?何となく標準添加法の感覚がつかめましたか?
後半はスパイクと関係なかったですが、この機会に標準添加法も覚えてもらえたら嬉しいです!

コメント
コメント一覧 (2件)
0.1mol/Lや0.5mol/Lはグラフのどこに行ったのでしょうか?また、X+0.5やX+1の0.5や1はどこの数字でしょうか?
コメントありがとうございます。
こちらで確認したところ、数字が誤っていたので訂正してあります。
また何かあればコメントしてくださると嬉しいです!!