ここでは、錯体化学における考え方の一つである配位子場理論を解説していきます。
もう一方の考え方である結晶場理論については下の記事をご覧ください!

配位子場理論とは?
まず配位子場理論の概要から行きたいと思います。
配位子場理論は、
「分子軌道理論を適用し中心金属イオンと配位子との軌道の重なりや対称性を考慮して電子構造を記述する方法」
という風に説明が出来ます。
錯体のσ結合・π結合
ここからは、配位子場理論をより深く学ぶために、八面体錯体の分子軌道をσ結合によるものとπ結合によるもので分けて考えます。
実は、少なくとも配位子場理論で錯体を考える時、この2つの軌道の重要性は同じではなくて、π結合の方がσ結合よりも重要です。
その分π結合について考えるのはすこし難しいので、まずσ結合から説明してきます!
始めは対称性を考えるのが大変ですが、頑張ってください!!
σ結合
配位子場理論は分子軌道を考える、ということを先ほど書きましたが、分子軌道の原則として、
「分子軌道は対称性が同じ原子軌道から作られる」
ということがあります。
つまり、全ての軌道が配位子の軌道とσ結合が出来るわけではないというわけです。
では、どの軌道が出来てどの軌道が出来ないのでしょうか。


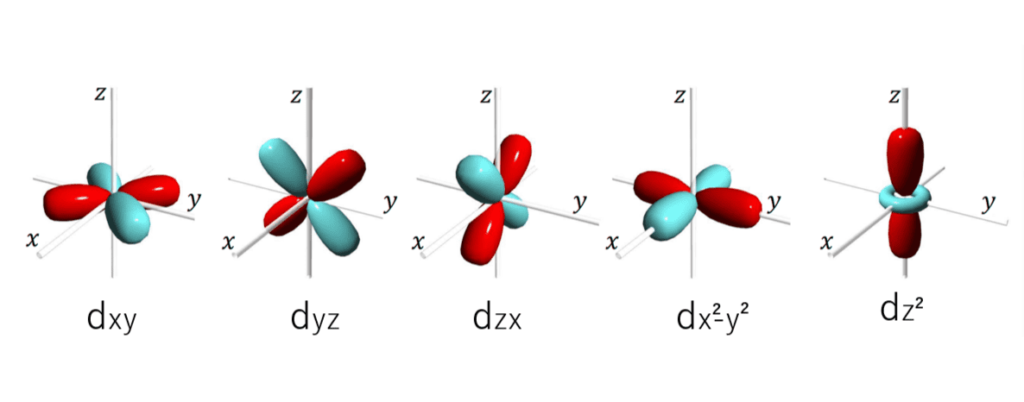
とりあえず、s軌道、pz軌道、d軌道(5種類)の概形を載せてみました。
この中でσ結合ができない軌道は3つあります。どれか分かりますか?
答えは、dxy軌道、dyz軌道、dzx軌道の3つです。
逆に言えばs軌道、p軌道(3つ)、dx2-y2軌道、dz2軌道たちはσ結合が出来るわけですね。
ここまでで5つのd軌道のうちdx2-y2軌道、dz2軌道の2つはσ結合が出来て、dxy軌道、dyz軌道、dzx軌道の3つはσ結合が出来ないことが分かりましたが、
今からdx2-y2軌道、dz2軌道の2つをeg軌道、dxy軌道、dyz軌道、dzx軌道の3つをt2g軌道と改めて呼ぶことにします。※eg軌道とt2g軌道の名前は、それぞれの対称性から来ています。
すると、(3d軌道で結合している)八面体錯体の分子軌道は次のようになります。
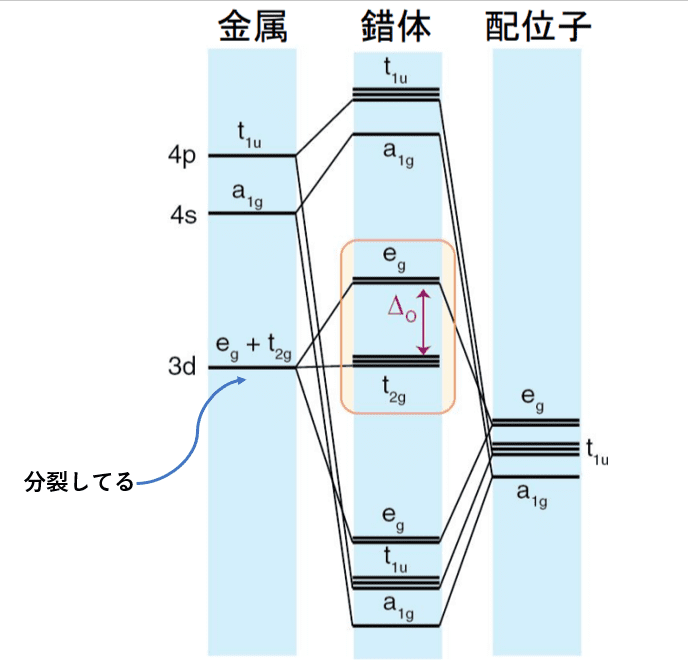
中心金属のeg軌道は配位子のeg軌道と分子軌道を作れるので、結合性軌道と半結合性軌道が出来ていますね。
一方、t2g軌道は配位子側に同じ対称性の軌道がないので、そのままです。
このようにして出来た、eg軌道(の結合性軌道)とt2g軌道のエネルギーの差をΔo(配位子場分裂パラメーター)と言います。Δoは結晶場理論でも出てきましたね。
π結合
錯体でのπ結合の重要性
σ結合については先ほどのまでで終わったので、次はπ結合について書きます。
実は配位子場理論で大事なのは、σ結合よりむしろπ結合です。
実際、分光化学系列(配位子を生じるΔoの大きさ順に並べたもの)は、π結合の効果(π効果)によって支配されていると考えていいです。
π結合を作る軌道
それでは八面体錯体のπ結合を説明していきます。
初めに「どの軌道がπ結合を作るのか」ですが、その答えはt2g軌道(dxy軌道、dyz軌道、dzx軌道の3つ)です。
これらはσ結合を作れない軌道でしたね。
これら3つのt2g軌道がπ結合を作っていくわけです。
配位子の種類による変化
ここでは配位子の種類がπ結合後にどう影響を及ぼすか(=Δoへの影響)を解説します。
前提知識として以下の2つの一般原理を紹介します。
- 原子軌道の重なりが強い時、それらの原子軌道は強く混ざり合う
- 似たエネルギーをもつ原子軌道同士は強く相互作用する
要は、原子軌道の重なりが大きく、またエネルギーが同じくらいであればより良いってことですね。
これは個人的に大事だと思うことなのですが、
原子軌道2つから分子軌道2つが形成されるとき、結合性分子軌道(エネルギー低)は原子軌道のうちエネルギーの低い軌道を、逆に反結合性分子軌道(エネルギー高)はエネルギーが高いほうの原子軌道の性質を持ちます。
これらを踏まえて、次の二つの例を見ていきましょう。
π供与体配位子
1つ目はπ供与体の配位子です。
この配位子は、結合する前からπ対称の軌道が既に埋まっています。
下の図を見てください。(中心金属の軌道は見やすいようにd軌道だけを抜き出しています。)
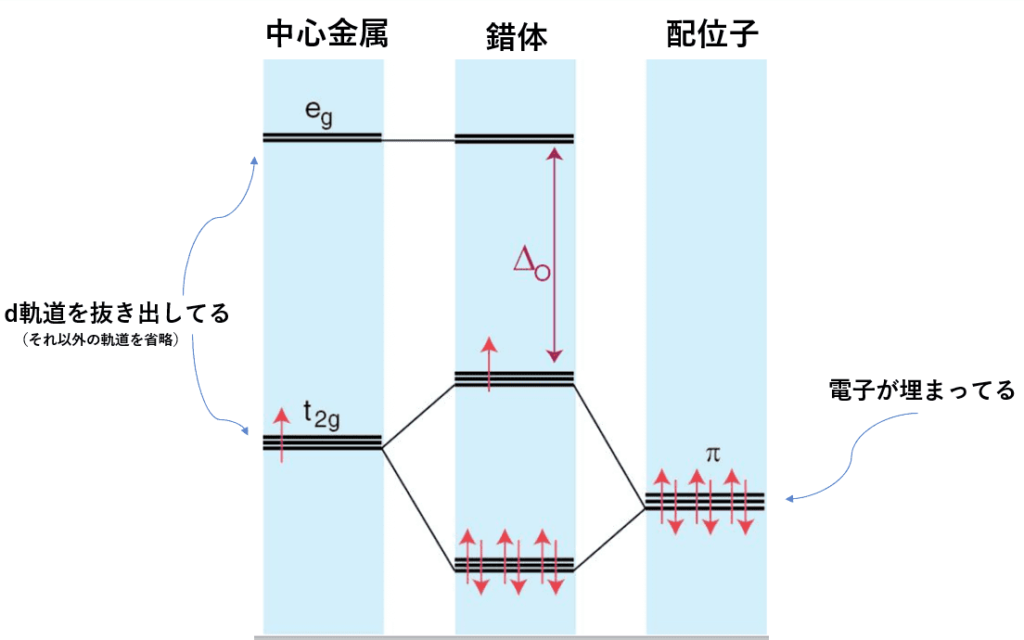
配位子のt2g軌道は、結合する前から電子が埋まっているのでその分安定化していて、金属のt2g軌道よりもエネルギーが低くなっています。
上にも書きましたが、原子軌道2つから分子軌道2つが形成されるとき、結合性分子軌道は原子軌道のうちエネルギーの低い軌道を、逆に反結合性分子軌道はエネルギーが高いほうの原子軌道の性質を持ちます。
したがって、金属のt2g軌道は反結合性分子軌道となります。
また図より、反結合性分子軌道のエネルギーは金属のt2g軌道より高いので、Δoは減少します。
というわけで、π供与体配位子はΔoを減少させます!
π受容体配位子
次はπ受容体配位子です。
π供与体配位子がΔoを減少させるなら、π受容体配位子はΔoを増大させるのでは、と予想できそうですね。
…実際その通りです。
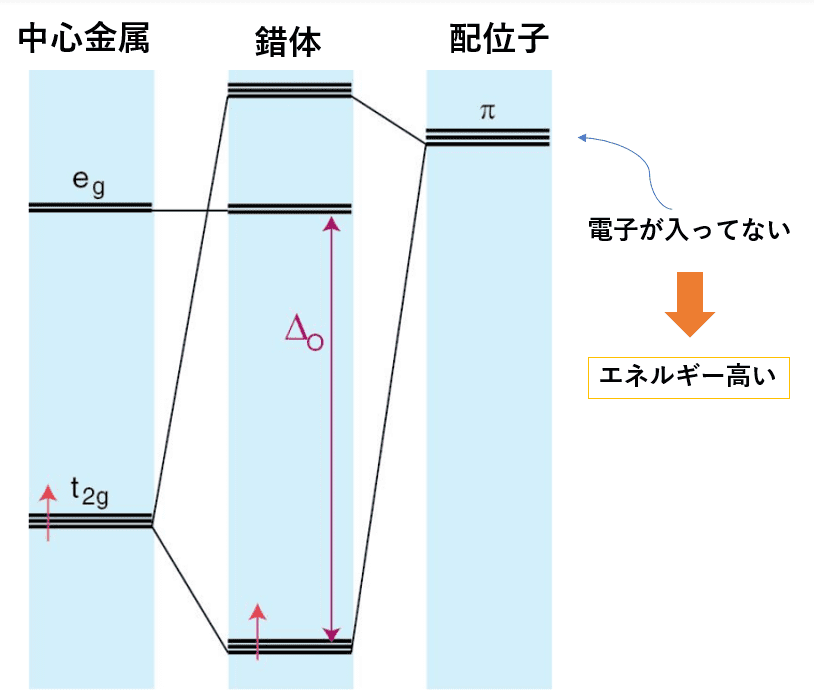
π受容体配位子は空のπ対称の軌道を持つ配位子で、電子を受け入れることが出来ます。
軌道は空っぽなのでエネルギーもその分高く、中心金属のt2g軌道のエネルギーよりも高いです。
よってさっきと逆のことが起きて、分子軌道を作った後、中心金属のt2g軌道は分子軌道のうちエネルギーの低い結合性分子軌道になります。
したがって、確かにπ受容体配位子はΔoを増大させることが分かりました。
分光化学系列との関係
π供与体配位子・π受容体配位子の2つをやりましたが、これらの話を使うと分光化学系列をほとんど説明することが出来ます。
分光化学系列の一部を取り出してΔoの小さい順に並べると
\(\ce{I- < Br- < S2- < SCN- < Cl- < NO3- < F- < OH- < H2O < CH3CN < NH3 < en < PPh3 < CN- < CO }\)
のようになりますが
左の方にある\(\ce{I-, Br-, Cl-}\)はπ供与体配位子であり、右の\(\ce{PPh3, CO}\)はπ受容体配位子です。
よって、分光化学系列が、供与体・受容体の配位子によるπ結合の効果(π効果)に支配されていることが確かめられました!
まとめ
今回は八面体錯体について扱っていることに注意してください!!
配位子場理論とは、
分子軌道理論を適用し中心金属イオンと配位子との軌道の重なりや対称性を考慮して電子構造を記述する方法
配位子の軌道とσ結合を作るのは、s軌道、p軌道(3つ)、dx2-y2軌道、dz2軌道。
dx2-y2軌道、dz2軌道の2つをeg軌道、dxy軌道、dyz軌道、dzx軌道の3つをt2g軌道と呼ぶ。
配位子の軌道とπ結合を作るのは、t2g軌道(dxy軌道、dyz軌道、dzx軌道の3つ)。
π供与型配位子はΔoを減少させ、π受容体配位子はΔoを増大させる。
分光化学系列は、π効果によって支配されている。
これで配位子場理論についての説明を終わります。お疲れさまでした!!

コメント