「なぜ周期表の元素たちは、あんな風に綺麗に性質が変化していくのだろう?」 理科の授業で周期表に触れたとき、誰もが一度は抱く疑問ではないでしょうか。金属元素が並ぶエリア、気体になる元素が集まるエリア、そして反応性に富んだハロゲンや、安定な貴ガス…。まるで元素たちが個性豊かに整列しているかのようです。
この元素たちの個性、つまり「性質」が周期的に変化するのには、実は原子レベルでの明確な理由が存在します。この記事では、元素の周期性が生まれる根本的な原因である**「電子配置の規則性」と「有効核電荷の影響」**という2つのキーワードを中心に、周期表の奥深い謎を解き明かしていきます。
1. 周期表と元素の周期性とは?
まず、おさらいです。周期表は、元素を原子番号の順に並べ、化学的性質の類似性に基づいて整理した表です。ロシアの科学者メンデレーエフがその原型を提案したことは有名ですね。
この周期表を見ると、以下の性質が周期的に変化することがわかります。
- 原子半径: 原子のおおよその大きさ
- イオン化エネルギー: 原子から電子を1個引き抜くのに必要なエネルギー
- 電子親和力: 原子が電子を1個受け取るときに放出するエネルギー
- 電気陰性度: 原子が共有電子対を引きつける強さの度合い
これらの性質は、周期表の縦の列である「族」では似たような傾向を示し、横の行である「周期」では原子番号が増えるにつれて一定の規則性を持って変化します。これが「元素の周期性」です。
では、なぜこのような周期性が生まれるのでしょうか?その鍵は、原子の構造、特に電子の振る舞いに隠されています。
2. 周期性の鍵①:電子配置の規則性
原子は、中心にある原子核(陽子と中性子からなる)と、その周りを飛び回る電子から構成されています。この電子は、無秩序に存在しているわけではなく、特定のエネルギー準位を持つ「電子殻」や「電子軌道」と呼ばれる領域に、一定のルールに従って収容されていきます。
- 電子殻: 内側からK殻, L殻, M殻…と呼ばれ、それぞれ収容できる電子の最大数が決まっています。
- 電子軌道: 各電子殻はさらに、s軌道, p軌道, d軌道, f軌道といった形の異なる電子軌道から構成されます。
- 電子配置のルール:
- 構成原理: 電子はエネルギーの低い軌道から順に満たされていく。
- パウリの排他原理: 1つの軌道には、スピンの向きが異なる最大2個の電子しか入れない。
- フントの規則: 同じエネルギー準位の複数の軌道(例:3つのp軌道)には、まず各軌道に1つずつ電子が入り、すべてが埋まった後に2つ目の電子が入る。
この電子配置のルールに従って電子が配置されていくと、ある重要なパターンが見えてきます。それは、**「最外殻電子配置の周期的な繰り返し」**です。
例えば、
- リチウム(Li): 1s² 2s¹
- ナトリウム(Na): 1s² 2s² 2p⁶ 3s¹
- カリウム(K): 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
これらは全て1族のアルカリ金属元素ですが、最も外側の電子殻(最外殻)の電子配置が「ns¹」という同じ形をしています(nは主量子数)。同様に、17族のハロゲン元素は「ns²np⁵」、18族の貴ガス元素は(ヘリウムを除き)「ns²np⁶」という最外殻電子配置を持ちます。
原子の化学的な性質は、主にこの最外殻電子の数や配置によって決まります。なぜなら、他の原子と反応する際にやり取りされるのは、基本的にこの最外殻電子だからです。したがって、最外殻電子配置が周期的に繰り返されることが、元素の化学的性質が周期的に変化する大きな理由の一つなのです。
3. 周期性の鍵②:有効核電荷とその影響
電子配置だけでは、周期の横方向での性質の滑らかな変化を完全に説明できません。ここで重要になるのが「有効核電荷 (Zeff)」という考え方です。
- 核電荷 (Z): 原子核中の陽子の数(=原子番号)に等しい正の電荷です。
- 遮蔽効果 (S): 最外殻電子よりも内側にある電子(内殻電子)は、原子核の正電荷を部分的に打ち消し(遮蔽し)、最外殻電子が感じる原子核からの引力を弱めます。
有効核電荷 (Zeff) とは、この遮蔽効果を考慮した上で、最外殻電子が実際に感じる原子核からの正味の引力のことです。簡単に Zeff ≈ Z – S と表されます。
同一周期での有効核電荷の変化
周期表で同じ周期(横の行)を右に進むと、原子番号 Z は1ずつ増加します。電子も1つずつ増えますが、これらは同じ最外殻(またはその内側のd軌道など)に充填されていきます。新たに加わる電子による遮蔽効果の増加は、核電荷 Z の増加量よりも小さいため、結果として有効核電荷 Zeff は周期を右に進むほど大きくなります。
つまり、周期の右側の元素ほど、最外殻電子は原子核からより強い力で引きつけられることになります。
同一族での有効核電荷の変化
同じ族(縦の列)を下に進むと、原子番号 Z は大きく増加し、同時に電子殻の数も増えます。最外殻電子はより外側の電子殻に存在することになり、内殻電子の数も大幅に増えるため、遮蔽効果 S も大きくなります。 その結果、最外殻電子が感じる有効核電荷は、族を下に進んでも劇的には変化しないか、わずかに増加する程度と考えられます(この点はモデルによって解釈が多少異なります)。しかし、それ以上に主量子数の増加(つまり、より外側の電子殻に電子が存在すること)の影響が大きくなります。
これらの電子配置と有効核電荷の周期的な変化が、具体的にどのように元素の性質に影響を与えるのかを見ていきましょう。
4. 具体的な性質の周期的変化と、その理由
4.1 原子半径
原子の大きさの目安である原子半径は、以下のように変化します。
- 同一周期(右へ): 小さくなる
- 理由: 有効核電荷が増加するため、最外殻電子が原子核により強く引きつけられ、原子全体が収縮する。
- 同一族(下へ): 大きくなる
- 理由: 電子殻の数が増加し、最外殻電子がより外側に存在するため。有効核電荷の増大効果よりも、電子殻の増加の影響が支配的。
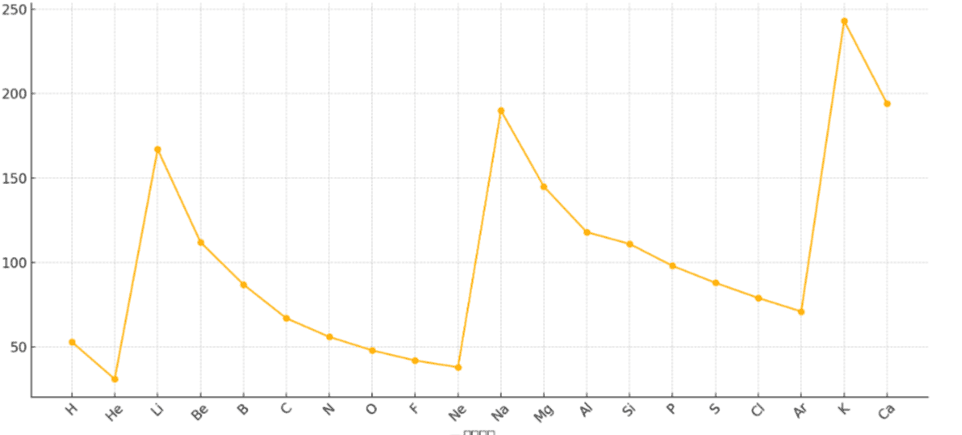
4.2 イオン化エネルギー
原子から電子を1個取り去って陽イオンにするのに必要なエネルギーです。
- 同一周期(右へ): 大きくなる
- 理由: 有効核電荷が増加し、最外殻電子が原子核に強く束縛されるため、電子を引き離すのにより多くのエネルギーが必要となる。
- (例外: Be→BやN→Oで一時的にイオン化エネルギーが低下する現象がありますが、これはp軌道のエネルギー準位やフントの規則に基づく電子配置の安定性が関係しています。)
- 同一族(下へ): 小さくなる
- 理由: 原子半径が大きくなり、最外殻電子が原子核から遠ざかるため、原子核からの束縛力が弱まり、電子を引き離しやすくなる。
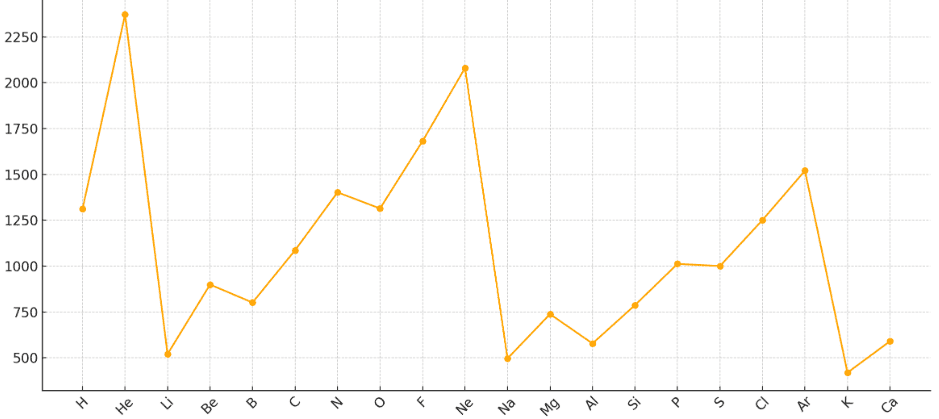
4.3 電子親和力
原子が電子を1個受け取って陰イオンになるときに放出するエネルギーの大きさです(定義によってはエネルギー変化で符号が逆になることもあります)。
- 同一周期(右へ): 大きく(より多くのエネルギーを放出する傾向に)なる
- 理由: 有効核電荷が増加し、原子半径が小さくなるため、新たに電子を受け入れる際に原子核からの引力が強く働き、より安定化しやすいため。特にハロゲン元素で顕著。
- (例外: 貴ガスは最外殻電子配置が安定なため電子を受け入れにくく、電子親和力は非常に小さいか負の値を取ります。また、BeやNなども安定な電子配置のため電子親和力は小さいです。)
- 同一族(下へ): 小さく(放出するエネルギーが少なくなる傾向に)なる
- 理由: 原子半径が大きくなり、新たに入ってくる電子と原子核との平均距離が遠くなるため、引力が弱まり、安定化の度合いが小さくなるため。
- (例外: フッ素(F)と塩素(Cl)では、原子の小さすぎるFよりも、適度な大きさを持つClの方が電子を受け入れやすく、電子親和力はClの方が大きくなります。)
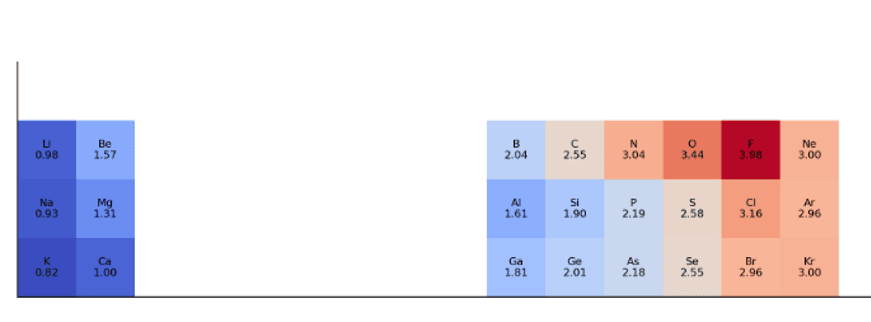
4.4 電気陰性度
原子が化学結合を形成した際に、共有電子対を自分の方へ引きつける強さの相対的な尺度です。
- 同一周期(右へ): 大きくなる
- 理由: 有効核電荷が増加し、原子半径が小さくなるため、原子核が共有電子対をより強く引きつけることができる。
- 同一族(下へ): 小さくなる
- 理由: 原子半径が大きくなり、原子核と共有電子対との距離が遠くなるため、引力が弱まる。
5. まとめ:なぜ周期性が生まれるのか?
ここまで見てきたように、元素の性質に見られる周期性は、決して偶然の産物ではありません。その根底には、
- 最外殻電子配置の周期的繰り返し: 同じ族の元素が似た化学的性質を示す直接的な原因。
- 有効核電荷の周期的変化: 同じ周期の元素の性質が連続的に変化していく主要な要因。
という、原子構造のレベルでのしっかりとした理由が存在します。これらの要因が、原子半径、イオン化エネルギー、電子親和力、電気陰性度といった具体的な物性値に影響を与え、私たちが目にする周期表上の美しいパターンのように現れているのです。
周期表は単なる元素のリストではなく、宇宙を構成する基本的な要素の性質とその背後にある法則性を見事に表現した「化学の地図」と言えるでしょう。この地図を読み解く鍵が、電子配置と有効核電荷なのです。
この記事が、元素の周期性に対するあなたの理解を深める一助となれば幸いです。化学の世界は、知れば知るほどその精巧さと美しさに驚かされます。ぜひ、さらに探求してみてください。

コメント