「モル(mol)」という言葉、化学の授業で必ず出てきますよね。「なんだか数が大きくて、よく分からない…」と感じている人もいるかもしれません。でも大丈夫!この記事を読めば、モルの概念がスッキリと理解できるようになりますよ。一緒にモルの世界を見ていきましょう!
モル(mol)とは一体何者?~6.02 × 1023個の秘密~
突然ですが、もしあなたが友達に「リンゴを1ダース買ってきて」と頼まれたら、いくつ買ってきますか?そう、12個ですよね。「ダース」という言葉が「12個の集団」を表すように、化学の世界には、原子や分子といった非常に小さな粒子を数えるための特別な単位があるんです。それが 「モル(mol)」 なのです。
そして、1モルは、約 6.02×1023 個の粒子(原子、分子、イオンなど)の集団 であると定義されています。この途方もなく大きな数、6.02×1023 は アボガドロ定数 と呼ばれています。
「え、なんでこんなに大きな数なの?」と思いますよね。原子や分子は、私たちが普段目にするものと比べて、信じられないほど小さいのです。例えば、水分子(H₂O)は非常に小さく、1滴の水の中に、なんと数兆個以上の水分子が含まれています。そのため、少量の物質でも、それを構成する粒子の数は膨大になるのです。モルは、そんな小さな世界を扱う上で、とても便利な単位なのです。
アボガドロ定数をイメージしてみよう!~途方もない数の実感を~
6.02×1023 という数は、あまりにも大きすぎて想像しにくいかもしれません。少し例え話でその大きさを実感してみましょう。
例1:秒数の場合
もし、あなたが1モルだけ秒数を数えてみるとしましょう。その数を数えようとしたら、地球上のすべての人々が一人1秒ずつ数えても、数え終わるまでに数兆年以上かかる計算になります!
例2:砂粒の場合
1モルの砂粒を集めると、なんと地球全体を覆ってしまうほどの量になると言われています。
これらの例えからも、1モルという単位が、非常に多くの粒子を含んでいることが想像できるでしょうか?
モルと質量を結びつける「モル質量」
さて、モルが「粒子の数」を表す単位であることは分かりました。では、私たちが普段質量を測る「グラム(g)」と、モルはどのように関係しているのでしょうか?
ここで重要なのが 「モル質量(Molar Mass)」 という考え方です。
モル質量とは、「1モルの物質の質量」のこと で、単位は通常「g/mol(グラム毎モル)」で表されます。
モル質量は、原子や分子の種類によって異なります。なぜなら、それぞれの原子や分子の質量が違うからです。
- 原子のモル質量: 周期表に記載されている 原子量 に、単位「g/mol」をつけたものが、その原子のモル質量になります。
- 例:水素原子(H)の原子量は約1.0なので、水素原子のモル質量は約1.0 g/mol です。つまり、水素原子が 6.02×1023 個集まると、その質量は約1.0 g になるということです。
- 例:炭素原子(C)の原子量は約12.0なので、炭素原子のモル質量は約12.0 g/mol です。
- 分子のモル質量: 分子を構成するすべての原子のモル質量の合計が、その分子のモル質量になります。
- 例:水分子(H₂O)の場合:
- 水素原子(H)のモル質量:約 1.0 g/mol
- 酸素原子(O)の原子量:約 16.0 なので、酸素原子のモル質量:約 16.0 g/mol
- 水分子(H₂O)のモル質量 = (1.0 g/mol × 2) + 16.0 g/mol = 18.0 g/mol つまり、水分子が 水分子(H₂O)のモル質量 = (1.0 g/mol × 2) + 16.0 g/mol = 18.0 g/mol つまり、水分子が 6.02×1023 個集まると、その質量は約 18.0 g になるということです。 個集まると、その質量は約 18.0 g になるということです。
- 例:二酸化炭素分子(CO₂)の場合:
- 炭素原子(C)のモル質量:約 12.0 g/mol
- 酸素原子(O)のモル質量:約 16.0 g/mol
- 二酸化炭素分子(CO₂)のモル質量 = 12.0 g/mol + (16.0 g/mol × 2) = 44.0 g/mol つまり、二酸化炭素分子が 6.02×1023 個集まると、その質量は約 44.0 g になるということです。
- 例:水分子(H₂O)の場合:
物質量、質量、粒子数の相互変換~これで計算も怖くない!~
モルの概念を理解したら、次は「物質量(mol)」、「質量(g)」、「粒子数(個)」を互いに変換する方法をマスターしましょう。これらは、化学計算の基本中の基本です。
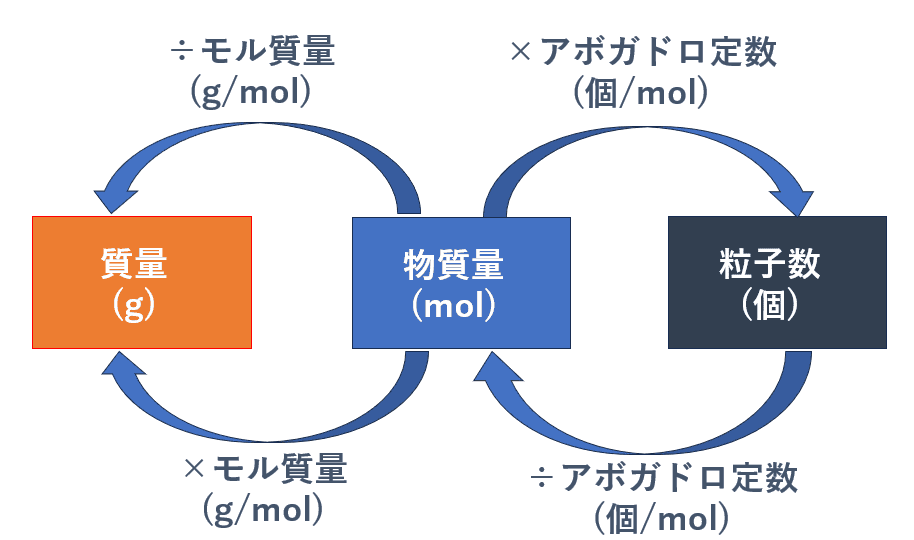
図解の補足:
- 物質量 [mol] → 質量 [g]: 物質量に モル質量 [g/mol] をかけます。
- 質量 [g] = 物質量 [mol] × モル質量 [g/mol]
- 質量 [g] → 物質量 [mol]: 質量を モル質量 [g/mol] で割ります。
- 物質量 [mol] = 質量 [g] ÷ モル質量 [g/mol]
- 物質量 [mol] → 粒子数 [個]: 物質量に アボガドロ定数 [6.02×1023 個/mol] をかけます。
- 粒子数 [個] = 物質量 [mol] × アボガドロ定数 [6.02×1023 個/mol]
- 粒子数 [個] → 物質量 [mol]: 粒子数を アボガドロ定数 [6.02×1023 個/mol] で割ります。
- 物質量 [mol] = 粒子数 [個] ÷ アボガドロ定数 [6.02×1023 個/mol]
この関係をしっかりと頭に入れておけば、モル計算に関する問題もスムーズに解けるようになりますよ!
練習問題にチャレンジ!~理解度をチェックしよう~
それでは、実際に具体的な物質を使って、質量から物質量、物質量から粒子数への変換問題を解いてみましょう。
問題1:水の質量から物質量を求める
水(H₂O)が 36.0 g あるとき、その物質量は何 mol ですか?
考え方:
- 水のモル質量を求めます。
- 水分子(H₂O)のモル質量 = (Hのモル質量 × 2) + (Oのモル質量)
- モル質量 = (1.0 g/mol × 2) + 16.0 g/mol = 18.0 g/mol
- 質量から物質量を求める公式を使います。
- 物質量 [mol] = 質量 [g] ÷ モル質量 [g/mol]
解答:
物質量 = 36.0 g ÷ 18.0 g/mol = 2.0 mol
したがって、水 36.0 g の物質量は 2.0 mol です。
問題2:二酸化炭素の物質量から粒子数を求める
二酸化炭素(CO₂)が 0.50 mol あるとき、その中に含まれる二酸化炭素分子は何個ですか?
考え方:
- 物質量から粒子数を求める公式を使います。
- 粒子数 [個] = 物質量 [mol] × アボガドロ定数 [6.02×1023個/mol]
解答:
粒子数 = 0.50 mol × 6.02times1023 個/mol = 3.01×1023 個
したがって、二酸化炭素 0.50 mol の中には、3.01×1023 個の二酸化炭素分子が含まれています。
まとめ~モルは化学の共通言語~
今回の記事では、モルという単位が、非常に多くの粒子をまとめて数えるための便利な単位であること、そして質量や粒子数と密接に関わっていることを解説しました。
- 1モルは約 6.02×1023 個の粒子の集団
- モル質量は1モルの物質の質量
- 物質量、質量、粒子数は互いに変換できる
モルの概念は、化学反応の量的関係を理解する上で非常に重要になります。今回の解説を参考に、ぜひモルを味方につけて、これからの化学の学習をさらに深めていってくださいね!

コメント