分子軌道論の講義でよく取り上げられるのが、H2とHe2の違いです。
僕自身も「どうして水素分子はあるのに、ヘリウム分子はないのか」を説明する課題を出されたことがあります。
そんな課題にも対応できるように、この記事ではHe2分子が形成されない理由を分子軌道論の観点から説明していきます。
あわせて読みたい


【5分で分かる】酸素が常磁性を持つ理由【分子軌道論】
今回は分子軌道論のちょっと応用的な内容について書いていきます。 大学の化学の講義で分子軌道論を扱ったときに、「酸素が常磁性を持つ」ってことをちらっと聞いたこと…
目次
分子軌道のエネルギーについて
分子軌道とは、簡単に言えば原子の軌道が重なってできる新しい軌道のことです。
結合性分子軌道と反結合性分子軌道があり、これらの数は絶対1:1になってます。
結合性軌道は元の軌道よりエネルギーが低く、反結合性軌道は元の軌道よりエネルギーが高いです。
また、結合性軌道で低くなるエネルギーよりも、反結合性軌道で高くなるエネルギーの方が大きいことは覚えといた方がいいです。
また、σ(シグマ)という記号を使って結合性軌道をσ、反結合性軌道をσ*と表すことも覚えておいてください!
水素の分子軌道のエネルギー図

1s軌道に一つだけ電子をもつ原子の二原子分子(H2, He2など)の分子軌道のエネルギー図を描いてみました。
それぞれの電子が結合性軌道に入って、反結合性軌道には電子が入っていないので、エネルギーは下がるだけですね。
原子・分子はエネルギーの低い方を好むことを考えて、分子になった方が自然だと分かります。
だから安定化するんですね!
ヘリウムの分子軌道のエネルギー図
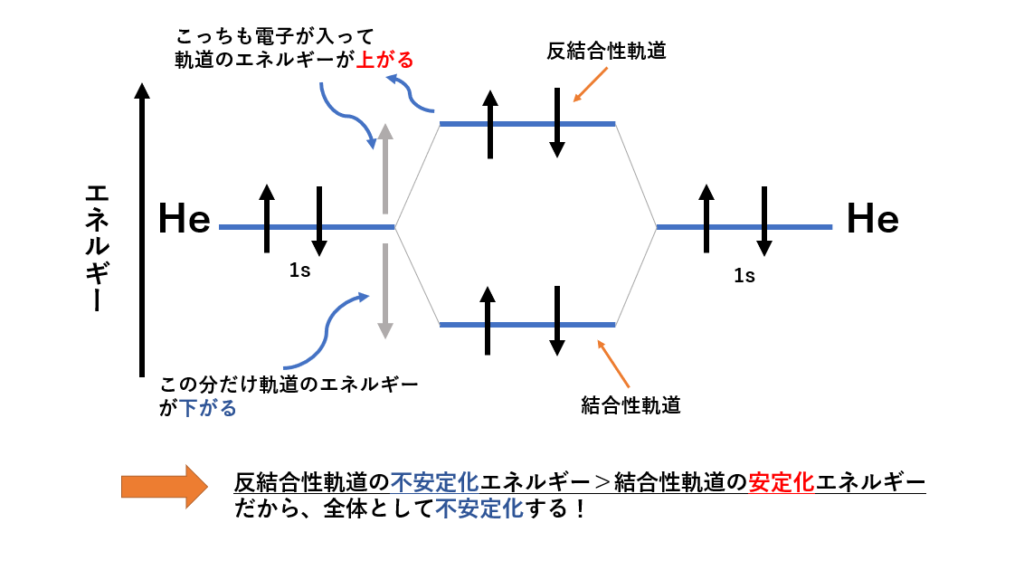
ヘリウムの分子を考えると、先ほどと違い、反結合性軌道にも電子が入っちゃっています。
その結果プラスマイナスで考えたとき、全体として軌道のエネルギーは結合前より高くなってしまいます。
原子・分子はエネルギーの低い方を好むので、不安定化してしまいますよね。
というわけで、「He2分子が(極低温でなければ)形成しない理由」でした。

コメント